sur CROSSJECT (EPA:ALCJ)
CROSSJECT : Progrès dans la demande d'autorisation EUA pour ZEPIZURE®
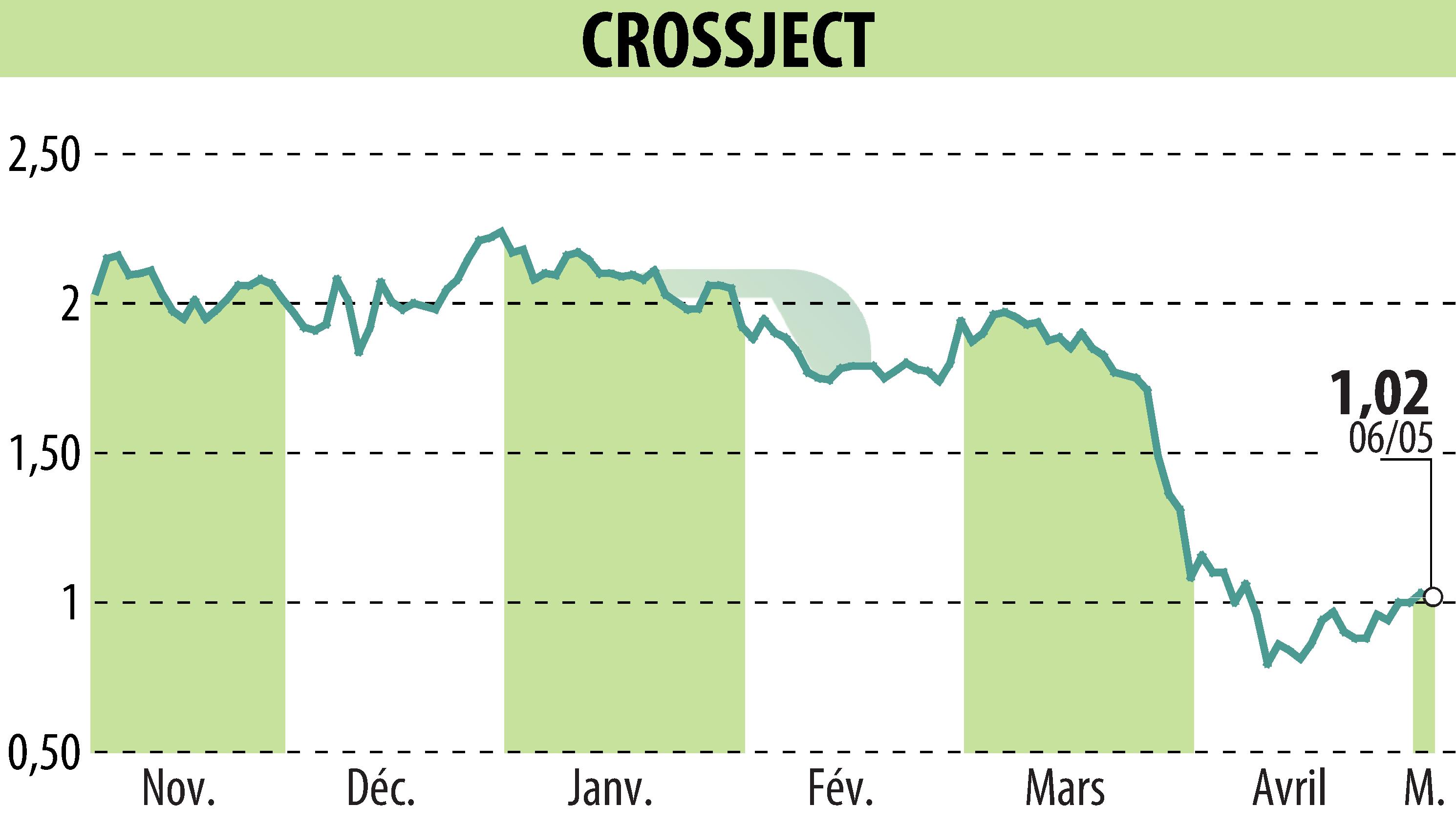
CROSSJECT a annoncé l'avancement de la demande d'autorisation d'utilisation d'urgence (EUA) de son produit ZEPIZURE® auprès de la FDA américaine. En collaboration avec EUROFINS CDMO, la société a terminé avec succès le remplissage aseptique des lots de registres requis. Ils prévoient de soumettre les dernières données de fabrication nécessaires d'ici juin 2025.
L'entreprise a initié les activités réglementaires finales pour soumettre le dossier ZEPIZURE® sous l'EUA, en coopération avec le BARDA, un partenaire aux États-Unis. Les lots pour l'EUA, destinés au programme CHEMPACK pour la préparation nationale aux menaces chimiques, ont également commencé leur production.
CROSSJECT reste optimiste quant à la réception de l'autorisation de la FDA dans le cadre de son partenariat avec BARDA, renforçant ainsi sa technologie d'injection sans aiguille ZENEO®.
R. H.
Copyright © 2026 FinanzWire, tous droits de reproduction et de représentation réservés.
Clause de non responsabilité : bien que puisées aux meilleures sources, les informations et analyses diffusées par FinanzWire sont fournies à titre indicatif et ne constituent en aucune manière une incitation à prendre position sur les marchés financiers.
Cliquez ici pour consulter le communiqué de presse ayant servi de base à la rédaction de cette brève
Voir toutes les actualités de CROSSJECT
