sur Nanohale AG (isin : DE000A1EWVY8)
La MHRA accorde son approbation à Formycon et à Otulfi® de Fresenius Kabi
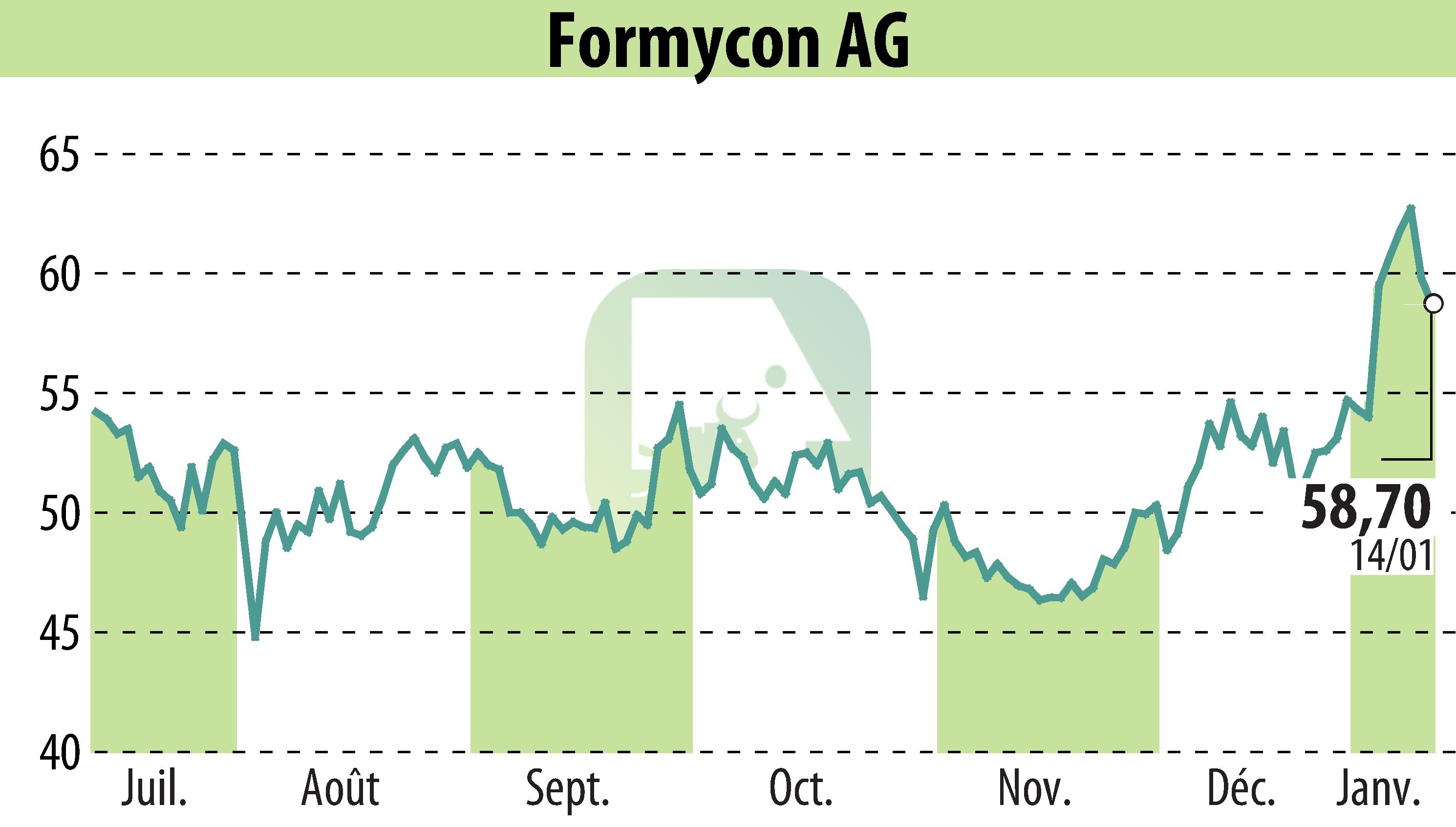
Formycon AG et Fresenius Kabi ont annoncé l'approbation par la Medicines and Healthcare products Regulatory Agency (MHRA) du FYB202/Otulfi® (ustekinumab), un biosimilaire de Stelara®. Cette approbation couvre les formes sous-cutanées et intraveineuses pour le traitement de la maladie de Crohn, de la rectocolite hémorragique, du psoriasis en plaques et de l'arthrite psoriasique. Cette autorisation fait suite aux approbations précédentes de la FDA, de la Commission européenne et de Santé Canada.
La commercialisation d'Otulfi® au Royaume-Uni est soumise à un accord confidentiel avec Johnson & Johnson. L'ustekinumab cible les cytokines interleukine-12 et interleukine-23, essentielles aux réponses inflammatoires. L'approbation résulte d'une évaluation approfondie des données d'efficacité, de sécurité et de fabrication.
Formycon, en partenariat avec Fresenius Kabi, vise à rendre les traitements biosimilaires de haute qualité et rentables accessibles à l'échelle mondiale, répondant ainsi à la demande croissante de traitements contre les maladies inflammatoires chroniques.
R. E.
Copyright © 2025 FinanzWire, tous droits de reproduction et de représentation réservés.
Clause de non responsabilité : bien que puisées aux meilleures sources, les informations et analyses diffusées par FinanzWire sont fournies à titre indicatif et ne constituent en aucune manière une incitation à prendre position sur les marchés financiers.
Cliquez ici pour consulter le communiqué de presse ayant servi de base à la rédaction de cette brève
Voir toutes les actualités de Nanohale AG
