sur MEDINCELL (EPA:MEDCL)
La suspension injectable d'olanzapine de Teva obtient l'approbation de la FDA
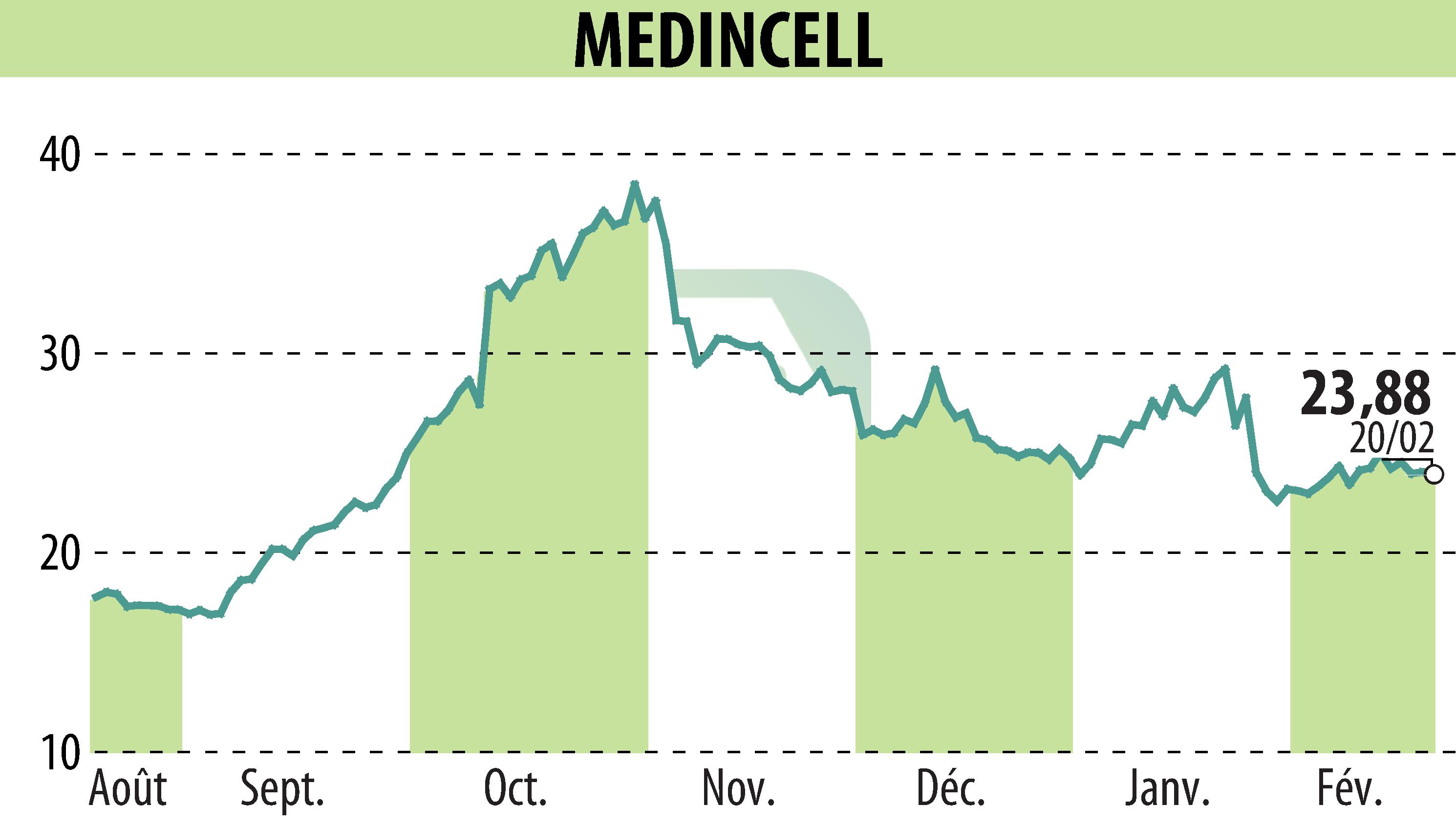
La FDA américaine a accepté la demande d'autorisation de mise sur le marché (AMM) de Teva Pharmaceuticals pour sa suspension injectable à libération prolongée d'olanzapine, connue sous le nom de TEV-'749. Ce traitement mensuel de la schizophrénie vise à améliorer l'observance du traitement par le patient et sa stabilité à long terme.
Actuellement, aucune formulation d'olanzapine à action prolongée n'existe sans stratégie d'évaluation et de réduction des risques (REMS). Les résultats de l'essai de phase 3 SOLARIS ont indiqué que le TEV-'749 présentait une efficacité et une sécurité comparables aux options existantes, éliminant potentiellement le besoin de surveillance post-injection.
Teva souligne le besoin non satisfait de solutions d'olanzapine à action prolongée, d'autant plus que l'olanzapine par voie orale quotidienne est largement utilisée. Medincell, en collaboration avec Teva, utilise sa technologie exclusive SteadyTeq™ pour une libération prolongée d'olanzapine, améliorant ainsi l'efficacité du traitement.
R. P.
Copyright © 2026 FinanzWire, tous droits de reproduction et de représentation réservés.
Clause de non responsabilité : bien que puisées aux meilleures sources, les informations et analyses diffusées par FinanzWire sont fournies à titre indicatif et ne constituent en aucune manière une incitation à prendre position sur les marchés financiers.
Cliquez ici pour consulter le communiqué de presse ayant servi de base à la rédaction de cette brève
Voir toutes les actualités de MEDINCELL
