sur Moderna, Inc. (NASDAQ:MRNA)
Moderna reçoit l'approbation de la FDA pour un vaccin COVID-19 mis à jour ciblant la variante KP.2
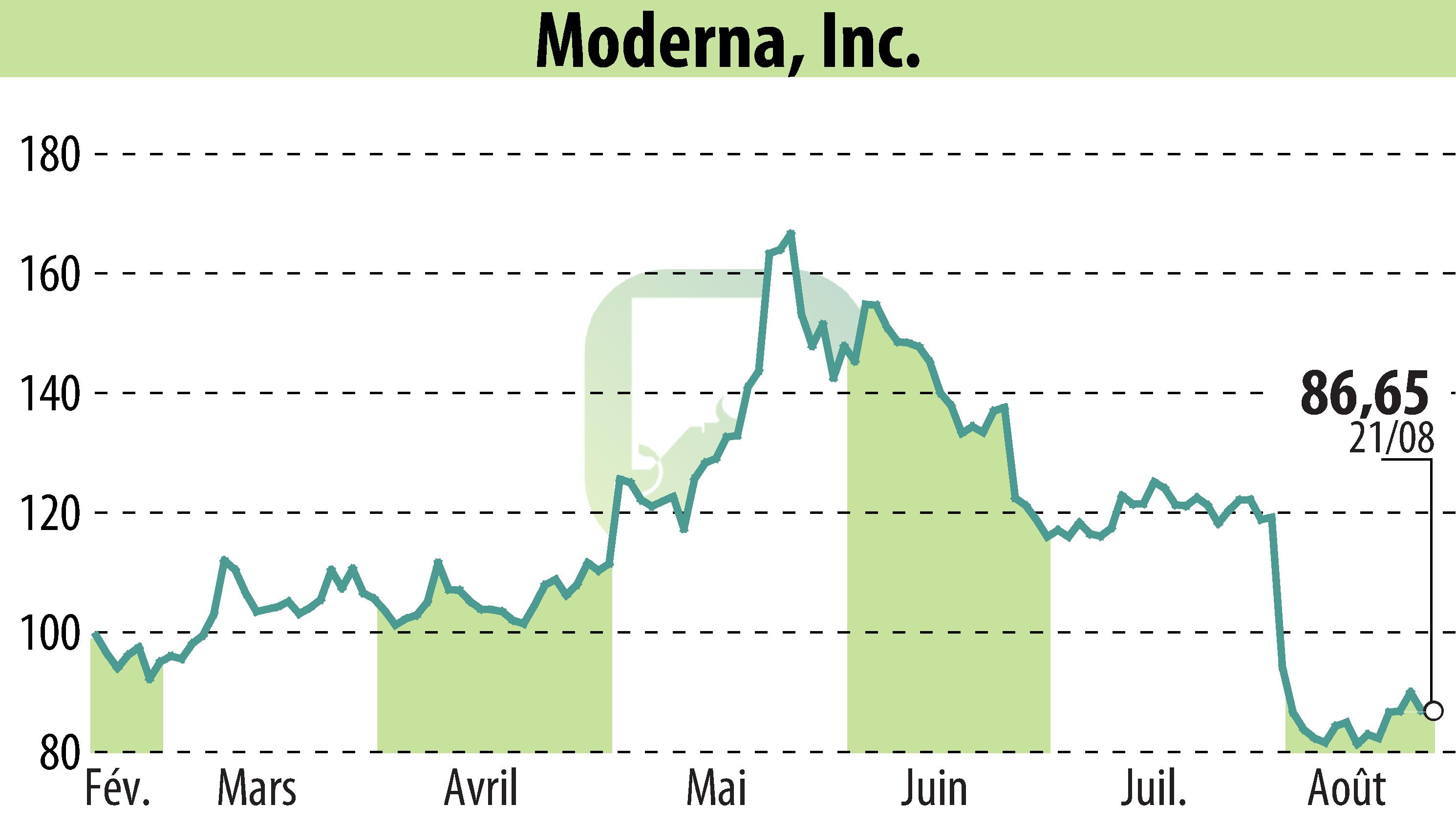
CAMBRIDGE, MA / ACCESSWIRE / 22 août 2024 - Moderna, Inc. (NASDAQ : MRNA) a annoncé que la FDA américaine a approuvé la demande de licence de produit biologique supplémentaire pour Spikevax® (formule 2024-2025) pour les personnes âgées de 12 ans et plus. Une autorisation d'utilisation d'urgence a été accordée aux personnes âgées de 6 mois à 11 ans.
Le vaccin cible la variante KP.2 du SARS-CoV-2 et sera disponible dans les pharmacies et les établissements de santé aux États-Unis dans les prochains jours. Le PDG de Moderna, Stéphane Bancel, a souligné l'importance de se tenir au courant des vaccinations contre la COVID-19 pour prévenir les formes graves de la maladie.
La décision de la FDA est fondée sur des données précliniques et des preuves antérieures soutenant l'efficacité et la sécurité du vaccin. Le vaccin mis à jour de Moderna contient une composition monovalente KP.2 comme recommandé par la FDA.
En plus du variant KP.2, Moderna développe également un vaccin ciblant le variant JN.1, et des décisions réglementaires sont attendues prochainement.
Les vaccins de Moderna ont été bien tolérés, les effets indésirables courants étant des douleurs au point d’injection, des maux de tête, de la fatigue, des myalgies et des frissons.
R. P.
Copyright © 2024 FinanzWire, tous droits de reproduction et de représentation réservés.
Clause de non responsabilité : bien que puisées aux meilleures sources, les informations et analyses diffusées par FinanzWire sont fournies à titre indicatif et ne constituent en aucune manière une incitation à prendre position sur les marchés financiers.
Cliquez ici pour consulter le communiqué de presse ayant servi de base à la rédaction de cette brève
Voir toutes les actualités de Moderna, Inc.
