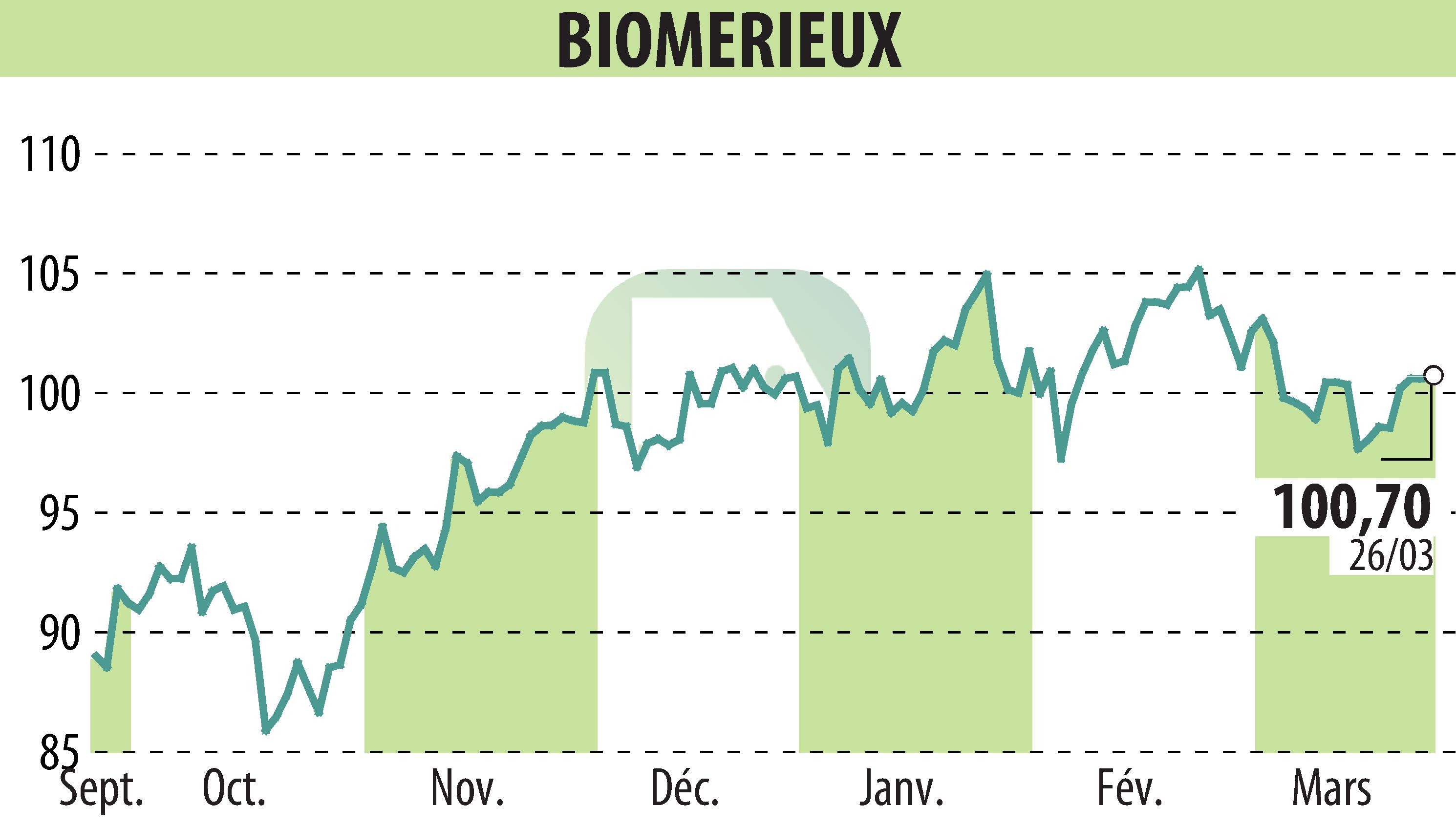
sur BIOMERIEUX (EPA:BIM)
BioMérieux obtient l'agrément 510(k) et la dérogation CLIA pour le panel BIOFIRE® SPOTFIRE® Respiratory/Sore Throat (R/ST)
Nouveau panel de diagnostic rapide et innovant pour les infections respiratoires et pharyngées
Par Regis PIERPONT - BioMérieux a obtenu l'agrément 510(k) et la dérogation CLIA de la Food and Drug Administration (FDA) américaine pour le panel BIOFIRE® SPOTFIRE® Respiratory/Sore Throat (R/ST). Ce test PCR multiplex unique permet de détecter et d'identifier en environ 15 minutes les acides nucléiques de 15 bactéries, virus et sous-types viraux les plus couramment responsables d'infections respiratoires ou pharyngées.
Les professionnels de santé peuvent désormais disposer de tests de diagnostic rapides et innovants, comme le panel BIOFIRE® SPOTFIRE® R/ST, pour répondre aux nouveaux besoins médicaux engendrés par la pandémie de COVID-19. La flexibilité de ce panel syndromique permet aux cliniciens de rechercher plusieurs pathogènes dont les signes et symptômes sont identiques pour les patients, ce qui permet de prendre des décisions éclairées lors de la consultation ambulatoire.
Le panel BIOFIRE® SPOTFIRE® R/ST est le troisième panel autorisé par la FDA sur le système BIOFIRE® SPOTFIRE®, avec deux autres panels disponibles : le BIOFIRE® SPOTFIRE® Respiratory (R) Panel et le BIOFIRE® SPOTFIRE® Respiratory (R) Panel Mini. Grâce à la dérogation CLIA, le système BIOFIRE® SPOTFIRE® et les panels concernés peuvent être utilisés par des personnes qui ne sont pas des professionnels de laboratoire et dans toutes les structures de soins.

