sur BIOMERIEUX (EPA:BIM)
BioMérieux obtient l’autorisation 510(k) de la FDA américaine pour son système d’antibiogramme VITEK® REVEAL™
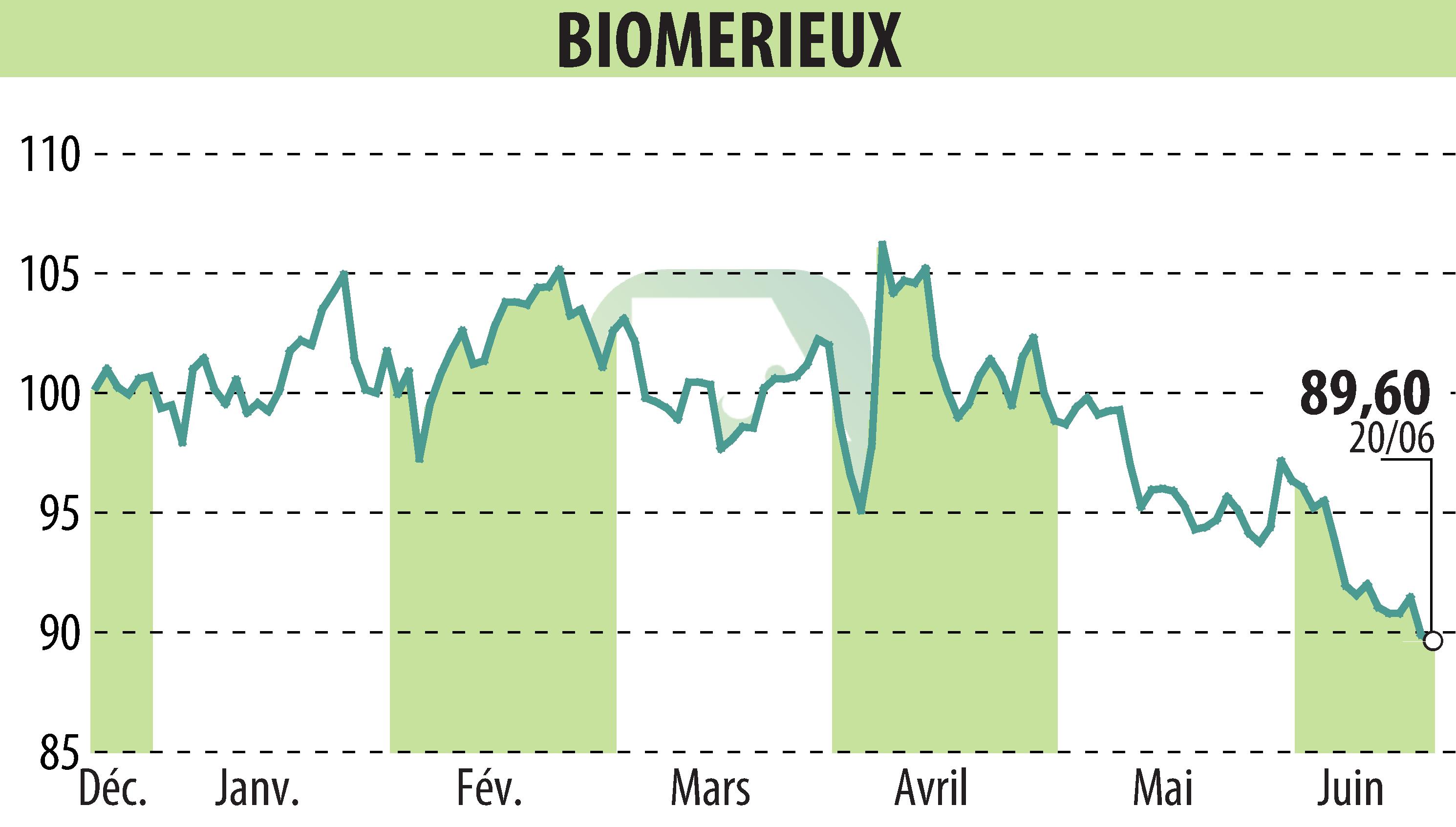
Marcy-l’Étoile (France), le 21 juin 2024 – bioMérieux annonce que son système d’antibiogramme VITEK® REVEAL™ a reçu l’autorisation 510(k) de la FDA américaine. Ce système fournit des résultats directement à partir d’hémocultures positives.
Chaque année, 11 millions de personnes meurent de sepsis, dont 1,3 million à cause de bactéries résistantes aux antibiotiques. Les antibiogrammes rapides sont essentiels pour optimiser les traitements. VITEK® REVEAL™ s'inscrit dans cette démarche.
Ce système, acquis par bioMérieux en 2022, fournit en 5,5 à 6 heures un test exploitable pour les bactéries à Gram négatif, facilitant des décisions thérapeutiques rapides pour les patients atteints de sepsis bactériémique.
La FDA avait déjà désigné VITEK® REVEAL™ comme « Breakthrough Device » en août 2022. En Europe, ce système bénéficie du marquage CE. Son développement a été partiellement financé par des fonds fédéraux américains.
R. E.
Copyright © 2024 FinanzWire, tous droits de reproduction et de représentation réservés.
Clause de non responsabilité : bien que puisées aux meilleures sources, les informations et analyses diffusées par FinanzWire sont fournies à titre indicatif et ne constituent en aucune manière une incitation à prendre position sur les marchés financiers.
Cliquez ici pour consulter le communiqué de presse ayant servi de base à la rédaction de cette brève
Voir toutes les actualités de BIOMERIEUX
